Research Background and Significance
mRNA 的非编码区(UTR)在决定其细胞内稳定性与翻译效率方面发挥关键作用,但系统评估其功能仍存在技术瓶颈。针对这一挑战,课题组建立了以萤火虫荧光素酶为报告基因的高通量筛选体系,实现了对不同 5'UTR 翻译效率的精确定量。进一步地,课题组开发了创新性的序列聚类策略,在显著缩小训练数据集规模的同时保持甚至提高模型的预测精度,从而能够比传统 TE(Translation Efficiency)指标更真实地反映 mRNA 治疗药物中的蛋白表达水平(Nucleic Acids Res. 2025, 53, gkaf861)。在 3'UTR 优化方面,课题组设计并插入具有增强活性的调控元件,通过锚定细胞质内天然 RNA 结合蛋白 HuR,有效提升 mRNA 稳定性并显著延长编码蛋白的半衰期,为提高 mRNA 药物体内表达持续性提供了新的策略(Mol. Ther. Nucleic Acids 2025, 102485)。此外,针对环状 RNA(circRNA)构建效率低、外源序列依赖性强等问题,课题组通过优化 3' 和 5' 剪接位点及其邻近同源臂,使 circRNA 在不引入任何外源片段的条件下实现高效环化,其效率可与 PIE 方法相当。所得 circRNA 在细胞中降解更慢、稳定性更高,为构建更安全、表达更持久的 circRNA 分子提供了新路径(Mol. Ther. Nucleic Acids 2025, 102626)。该策略避免了额外序列插入,显著提升环化精度,为 circRNA 未来在疫苗、蛋白替代治疗及长效基因表达领域的应用提供了重要启示。
Core Methods and Technologies
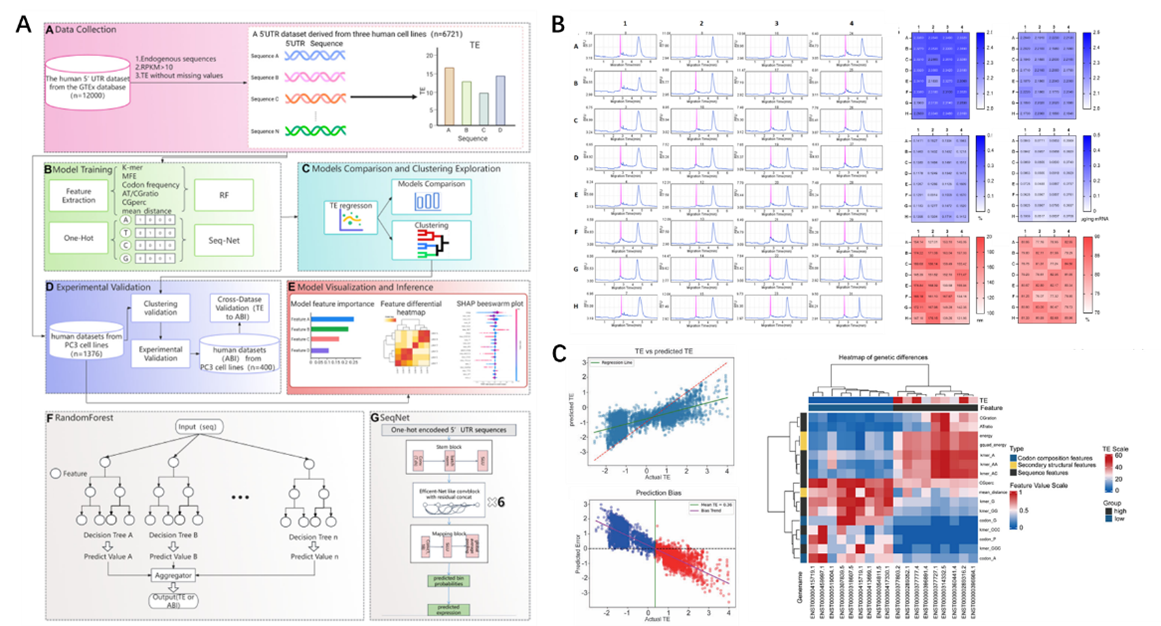
图1. (A)研究流程图:包括数据收集、模型训练、聚类探索、湿实验验证、模型可视化和分析。(B)高通量5’UTR库mRNA合成均一性验证。(C)本实验编辑效率和传统TE的回归拟合与编辑效率的特征差分热图。